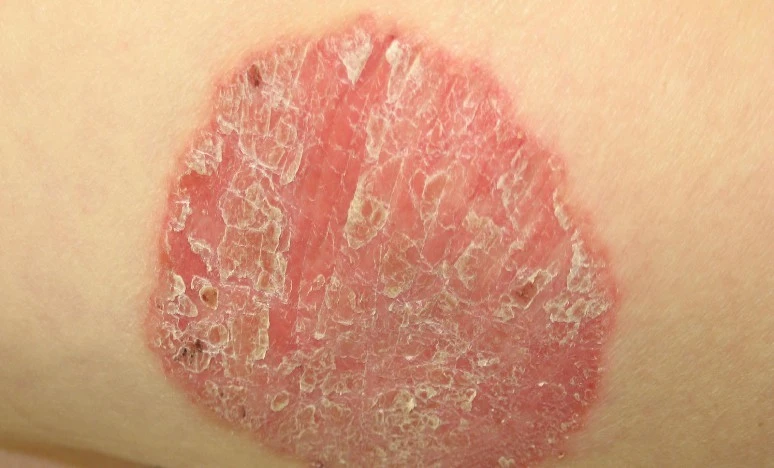
La Commissione Europea (CE) ha rilasciato l’autorizzazione all’immissione in commercio di tildrakizumab di Almirall, un anticorpo monoclonale IL-23p19 umanizzato e ad alta affinità, per il trattamento di pazienti adulti con psoriasi cronica a placche da moderata a grave candidati per terapia sistemica. Il lancio di Ilumetri in Europa inizierà nelle prossime settimane. La Germania sarà il primo paese a commercializzare il prodotto. "Siamo orgogliosi dell'approvazione della Commissione europea per Ilumetri, in quanto costituisce una nuova opzione terapeutica per gli operatori sanitari europei e per i pazienti con psoriasi cronica a placche da moderata a grave - afferma Peter Guenter, CEO di Almirall - Ilumetri è un inibitore IL-23p19 mirato, sicuro, facile da somministrare, che fornisce un’efficacia duratura e una sicurezza a lungo termine. Questo segna una pietra miliare molto importante per Almirall nell'area della dermatologia medica, in particolare nel mercato dei farmaci biologici". Tildrakizumab grazie al suo meccanismo d'azione specifico, blocca selettivamente l'interleuchina-23 (IL-23), una citochina a monte della cascata infiammatoria e agisce modificando la patogenesi della malattia con un impatto limitato sul resto del sistema immunitario. Il tildrakizumab costituisce un significativo passo avanti nel trattamento della psoriasi a placche cronica da moderata a grave, è un farmaco con un alto livello di sicurezza ed efficacia che consente di ottenere un controllo a lungo termine della malattia. Ilumetri viene somministrato per iniezione sottocutanea. Il suo facile regime di dosaggio, una somministrazione ogni 3 mesi durante il periodo di mantenimento, si traduce in una maggiore comodità e qualità di vita per i pazienti, ottenendosi un migliore controllo ed una migliore soddisfazione. Con solo 4 dosi all'anno durante il periodo di mantenimento, Ilumetri offre un comodo regime di dosaggio. Questa bassa frequenza di iniezioni può anche migliorare l’aderenza alla terapia. La sua approvazione in Europa si basa sui risultati positivi degli studi reSURFACE 1 e 2, presentati per la prima volta nell'ottobre 2016 al 25° Congresso europeo di Dermatologia e Venerologia (Eadv) a Vienna (Austria). Entrambi gli studi clinici di fase III, che hanno coinvolto oltre 1.800 pazienti provenienti da più di 200 centri clinici in tutto il mondo, hanno dimostrato che Ilumetri ha un alto livello di sicurezza ed efficacia. Secondo i dati di entrambi gli studi, una media del 63 per cento dei pazienti ha ottenuto il 75 per cento della clearance cutanea (PASI 75) alla settimana 12 e una media del 78 per cento alla settimana 28 dopo solo tre dosi. I risultati di un'analisi aggregata a 3 anni dagli studi RESURFACE 1 e RESURFACE 2 di fase III mostrano il costante mantenimento dell'efficacia e della sicurezza in tre anni di trattamento con Ilumetri in pazienti con psoriasi cronica a placche da moderata a grave che hanno risposto alla settimana 28. Secondo i dati, le risposte al PASI 75 sono state mantenute con il trattamento continuato con Ilumetri in 9 pazienti su 10 fino alla settimana 148. Più del 50 per cento dei pazienti ha riferito che la psoriasi non ha più peggiorato la vita dopo solo 3 dosi. Ilumetri è stato ben tollerato con una bassa incidenza di eventi avversi gravi e tassi di interruzione del trattamento. (A. C.)