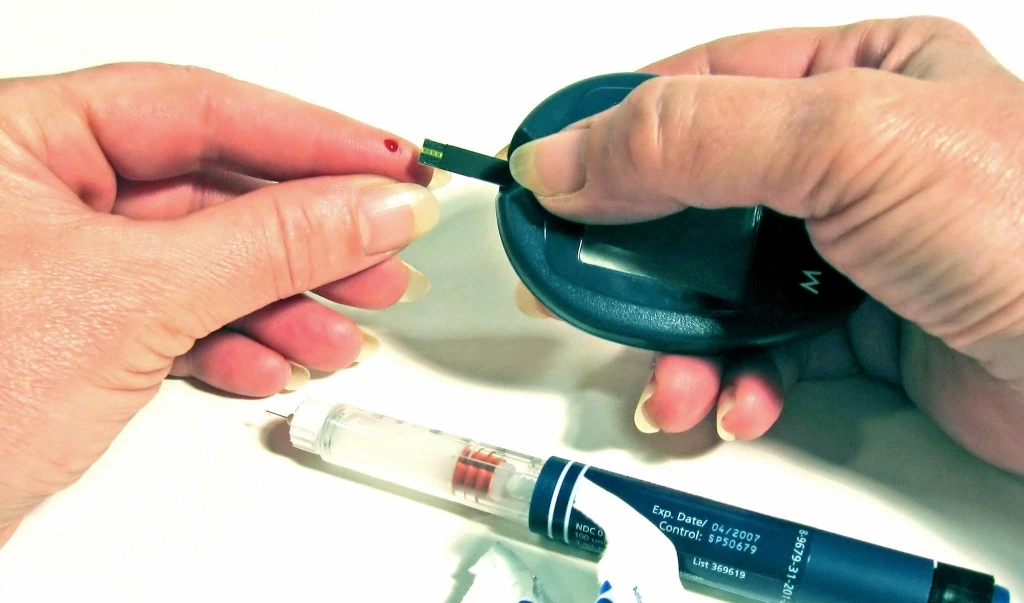
Rivedere al più presto la procedura di attribuzione del marchio CE ai dispositivi medici, per evitare un nuovo caso PIP (le protesi mammarie difettose) anche in diabetologia. E’ quanto chiedono gli esperti della Società Italiana di Diabetologia (SID), condividendo pienamente la linea della società europea di diabetologia (EASD). I diabetologi italiani chiedono inoltre l’istituzione di un registro nazionale per i malfunzionamenti dei microinfusori di insulina e un più attento monitoraggio post-marketing dei device. “Le tecnologie applicate al diabete – afferma il professor Stefano Del Prato, Presidente della Società Italiana di Diabetologia - rappresentano un enorme potenziale per i pazienti e non sono assolutamente da demonizzare, anzi. L’idea di SID, in sintonia con EASD, è quella di poterli utilizzare con sempre maggiore sicurezza. Per questo è necessario adottare misure di verifica di affidabilità e sicurezza più severe, sia in fase di autorizzazione, sia dopo la loro immissione sul mercato. L’attuale normativa per l’approvazione dei device in Europa non è sufficientemente adeguata alla complessità dei device oggi disponibili, nel diabete come in altri campi”. “I dispositivi per il controllo della glicemia, i microinfusori, i sensori in continuo della glicemia - afferma la dott.ssa Daniela Bruttomesso, del gruppo di studio intersocietario SID-AMD-SIEDP Tecnologia e Diabete - sono strumenti entrati ormai a far parte delle strategie di trattamento del diabete e i progressi della tecnologia fanno presagire a breve risultati ancora più importanti, quali i dispositivi ad ansa chiusa (il cosiddetto ‘pancreas artificiale’). Questi strumenti consentono un più efficace controllo della malattia, una maggior flessibilità e adattamento alle necessità individuali e migliorano significativamente la qualità della vita”. Via libera dunque alle soluzioni tecnologiche per le persone con diabete. Ma il problema è che al momento, la procedura di attribuzione del marchio CE (Conformité Européenne) - che, una volta ottenuto, è di fatto un lasciapassare per l’immissione in commercio di un device in tutti i Paesi dell’Unione Europea - non è del tutto lineare e trasparente. Per cominciare, il marchio CE non viene attribuito da un’agenzia europea, ma da un Notified Body (ne esistono circa una settantina che fanno questo lavoro). I Notified Body sono enti, spesso privati (altre volte collegati ad istituti universitari), che operano in diversi Paesi; l’azienda produttrice di un device, per ottenere il marchio CE presenta il suo dossier al Notified Body, pagando una commissione perché questo venga esaminato. Una volta ottenuto il marchio CE, il device può essere immesso sul mercato di qualche Paese europeo, senza che questo debba sottostare ad ulteriori controlli. “E’ fondamentale – prosegue la dottoressa Bruttomesso - che il processo di regolamentazione, immissione in commercio, verifica e sorveglianza post-marketing di questi dispositivi sia il più efficace, scientifico e indipendente possibile, per evitare abusi e leggerezze che possono compromettere l’efficacia degli strumenti e la salute degli utenti. Un modello alternativo a quello vigente esiste ed è l’agenzia SKUP (Scandinavian Evaluation of Laboratory Equipment for Primary Care, http://www.skup.nu/) che ha implementato nei Paesi scandinavi un sistema di verifica continua dei misuratori di glicemia, che si basa su agenzie esterne e pareri di esperti, certifica i vari passaggi e rende pubblici tutti i dati acquisiti, promuovendo di fatto un circolo virtuoso di controlli, verifiche e miglioramento del servizio agli utenti. Se un device non supera gli standard richiesti dallo SKUP, anche se dotato del marchio CE, non può essere immesso sul mercato scandinavo”. Altrettanto importante è una valutazione post-marketing più attenta, periodica e indipendente, con controlli a campione, banche-dati dei dispositivi in uso e criteri di verifica centralizzati e periodicamente aggiornati. “Anche le aziende serie del settore – ricorda la dottoressa Bruttomesso - vogliono una maggiore regolamentazione, per paura di produttori che ottengano l’approvazione di prodotti non sicuri, e che possano potenzialmente danneggiare la reputazione dell’intera classe dei dispositivi”. Istituire un registro nazionale o regionale per i malfunzionamenti dei microinfusori di insulina e migliorare il sistema di sorveglianza post-marketing per i glucometri, con controlli a campione, eseguiti da agenzie indipendenti, è la seconda parte della proposta dei diabetologi italiani. “Nel recente documento intersocietario AMD-SID-SIEDP-OSDI- SiBIOC-SIMET – prosegue la dottoressa Bruttomesso - si indica l'opportunità che la valutazione dei glucometri sia affidata ad un’Agenzia Nazionale super partes. In ogni caso, per i glucometri sarebbe importante definire standard ISO più stringenti e clinicamente più adeguati”. “La sorveglianza post-marketing è al momento molto insufficiente – afferma il professor Del Prato - mentre sarebbe necessario monitorare cosa accade quotidianamente nella vita reale, mettendo a punto dei modelli di valutazione con immediata segnalazione di ogni avaria o difetto ai registri nazionali ed europei. Al fine di acquisire la virtuosa collaborazione delle aziende produttrici, ribadiamo l’invito, già formulato dall’EASD, di ammettere al rimborso delle compagnie di assicurazione e dei sistemi sanitari nazionali, solo i presidi tecnologici delle aziende sottoposte a questo monitoraggio. Le persone con diabete, sia di ‘tipo 1’ che, soprattutto, di ‘tipo2’ - conclude il professor Del Prato - sono in aumento in Europa e in Italia. Questo significa che sempre più persone con diabete ricorreranno all’utilizzo di un device. Oggi si tratta di microinfusori di insulina e di glucometri, ma presto potrebbe trattarsi del cosiddetto ‘pancreas artificiale’, un sistema chiuso che autonomamente misura la glicemia, sulla scorta della quale eroga le unità di insulina, in quantità tale da garantire lo stretto controllo della glicemia. E’ necessario dunque che le normative e i controlli per l’immissione in commercio di queste apparecchiature siano rigorose, a garanzia della salute della persona con diabete”. (LAURA MONTI)