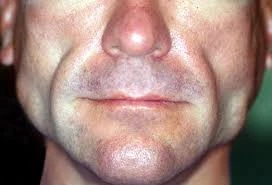
Il Comitato per i medicinali per uso umano (Chmp) dell'Agenzia europea per i medicinali (Ema) ha raccomandato l'approvazione condizionata di metreleptina per il trattamento di pazienti con lipodistrofia (LD) parziale o generalizzata. La raccomandazione del Chmp è relativa all'impiego del farmaco della Novelion Therapeutics Inc., una società biofarmaceutica impegnata nello sviluppo di nuovi standard di cura per le persone affette da malattie rare, in aggiunta alla dieta, come terapia sostitutiva per il trattamento delle complicanze legate al deficit di leptina negli adulti e nei bambini di età pari o superiore a 2 anni, con diagnosi confermata di lipodistrofia generalizzata congenita (sindrome di Berardinelli-Seip) o di lipodistrofia generalizzata acquisita (sindrome di Lawrence); oppure negli adulti e nei bambini di età pari o superiore a 12 anni, con diagnosi confermata di lipodistrofia parziale familiare o lipodistrofia parziale acquisita (sindrome di Barraquer-Simons), che non siano stati in grado di raggiungere un adeguato controllo dei disturbi metabolici attraverso gli attuali trattamenti standard. Il parere positivo del Chmp sarà ora valutato dalla Commissione Europea, a cui spetta la decisione definitiva sull'approvazione del farmaco per la suddetta indicazione. Si prevede che il responso ufficiale della Commissione Europea giunga intorno alla metà del 2018. Se approvato, questo farmaco diverrà il primo e unico trattamento ad aver ricevuto l'autorizzazione nell'Unione Europea come terapia sostitutiva, in aggiunta alla dieta, per il trattamento delle complicanze da deficit di leptina nei pazienti con LD, e in Europa ha già ricevuto la designazione di farmaco orfano. “La lipodistrofia è una condizione grave e rara, caratterizzata dalla perdita di tessuto adiposo – ha dichiarato Murray Stewart, vice presidente esecutivo e responsabile del settore Ricerca e Sviluppo presso Novelion Therapeutics – In alcuni pazienti la malattia è ereditaria, mentre in altri può essere acquisita. La perdita di tessuto adiposo provoca un deficit dell'ormone noto come leptina, che porta a possibili complicanze metaboliche come ipertrigliceridemia, insulino-resistenza e iperglicemia. La raccomandazione del CHMP è stata accolta favorevolmente dalla comunità medica, che ha bisogno di disporre di opzioni terapeutiche efficaci per i pazienti con lipodistrofia generalizzata e parziale”. Jeffrey Hackman, chief operating officer di Novelion Therapeutics, ha aggiunto: “L'opinione positiva del CHMP rappresenta un traguardo importante per la nostra azienda, e ancor più importante per tutte le persone che soffrono di lipodistrofia generalizzata o parziale. L'Europa costituisce un ampio mercato, con un numero significativo di pazienti con lipodistrofia già trattati con la metreleptina attraverso un programma di accesso anticipato al farmaco. In attesa dell'approvazione ufficiale da parte della Comunità Europea, non vediamo l'ora di poter collaborare con i medici, le associazioni di pazienti e le altre figure coinvolte per riuscire a fare in modo che queste persone possano disporre stabilmente della metreleptina, e per portare il trattamento a tutti coloro che ne abbiano bisogno”. Se la Comunità Europea dovesse confermarne l'approvazione condizionata, saranno richieste alla società farmaceutica produttrice alcune misure di minimizzazione del rischio e diversi obblighi post-autorizzazione, compreso lo svolgimento di ulteriori studi che consentano di valutare in modo approfondito l'impatto del farmaco sui pazienti con lipodistrofia generalizzata e parziale. (ANDREA COEN TIRELLI)