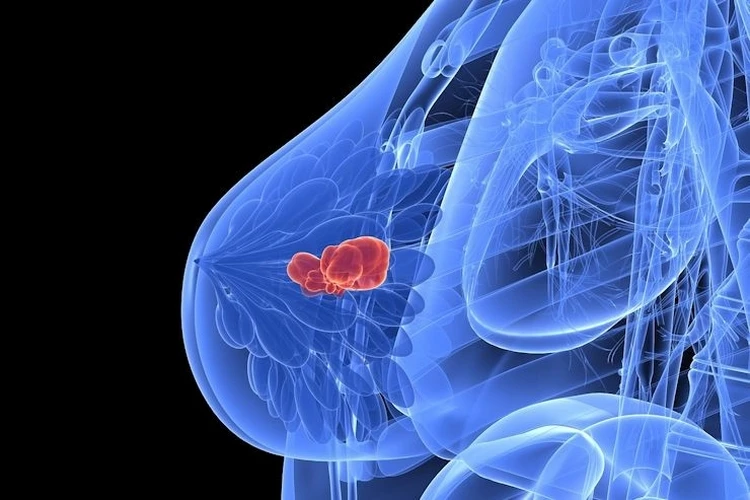
La Commissione Europea ha approvato atezolizumab in associazione al chemioterapico nab-paclitaxel come trattamento di prima linea per pazienti con tumore al seno triplo-negativo localmente avanzato non resecabile o metastatico (mTNBC), positivo al biomarcatore PD-L1 (≥ 1 per cento), non precedentemente trattati con chemioterapia per la malattia metastatica. Il test VENTANA PD-L1 (SP142) di Roche ha ottenuto il marchio CE ed è ora disponibile in Europa come test utile ad identificare i pazienti con TNBC elegibili al trattamento con atezolizumab in associazione. “Una diagnosi di carcinoma mammario metastatico triplo-negativo, PD-L1 positivo mette le pazienti e noi oncologi difronte a una delle forme più aggressive e difficili da trattare di tumore al seno e per le quali non si avevano a disposizione, finora, delle opzioni terapeutiche mirate – sottolinea il professor Michelino De Laurentiis, direttore del Dipartimento di Oncologia Mammaria e Toracica dell’Istituto Nazionale dei Tumori, Fondazione Pascale di Napoli – L’approvazione dell’agenzia europea del farmaco è stata sostenuta dagli importanti risultati dello studio IMpassion130, che per la prima volta hanno dimostrato che l’utilizzo di una immunoterapia come atezolizumab, in associazione alla chemioterapia, possa generare un vantaggio terapeutico in termini di controllo della malattia e di sopravvivenza. Questa approvazione è passo in più verso la disponibilità del trattamento anche in Italia. La speranza è che l’ulteriore iter burocratico per rendere disponibile il farmaco in tutti gli ospedali italiani si concluda nel giro di pochi mesi, visto l’elevato numero di pazienti che soffrono di questa forma avanzata e aggressiva di malattia”. "Negli ultimi 30 anni ci siamo impegnati per trasformare la vita delle persone con cancro al seno e siamo ora lieti di poter consolidare la nostra esperienza annunciando la disponibilità in Europa del primo trattamento immunoterapico per le pazienti affette da carcinoma mammario PD-L1-positivo, metastatico e triplo-negativo – dichiara Sandra Horning, MD, Chief Medical Officer di Roche e Head of Global Product Development – L'approvazione europea del trattamento con atezolizumab, associato a chemioterapia, rappresenta un significativo passo avanti nel trattamento di questa forma aggressiva di cancro al seno, dove il bisogno medico insoddisfatto è ancora molto importante". L'approvazione europea si basa sui risultati dello studio di fase III IMpassion130. I dati relativi alla sopravvivenza libera da progressione (PFS) hanno dimostrato un beneficio statisticamente significativo per atezolizumab in associazione alla chemioterapia nab-paclitaxel, e sottolineano come tale combinazione abbia ridotto significativamente il rischio di peggioramento della malattia o di morte (PFS) del 38 per cento rispetto al solo nab-paclitaxel (PFS mediana=7.5 vs 5 mesi; hazard ratio [HR]=0.62, 95 per cento CI: 0.49-0.78, p<0.0001) in pazienti che erano risultati positivi all'espressione di PD-L1 su cellule immunitarie infiltranti il tumore. Alla seconda analisi intermedia, atezolizumab e nab-paclitaxel hanno mostrato un miglioramento clinicamente significativo della sopravvivenza globale (OS) di sette mesi rispetto al placebo e nab-paclitaxel nella popolazione PD-L1-positiva (OS mediana=25.0 vs 18.0 mesi; HR=0.71, 95 per cento CI: 0.54 -0.93). I risultati di OS nella popolazione PD-L1-positiva non sono stati formalmente testati a causa del disegno gerarchico dello studio in quanto la significatività statistica per la OS nella popolazione intention-to-treat (ITT) non è stata raggiunta (OS mediana=21.0 vs 18.0 mesi; HR=0.86, 95 per cento CI: 0.72 -1.02. p=0.078). La valutazione di PD-L1 sulle cellule immunitarie infiltranti il tumore è essenziale per identificare i pazienti con TNBC che possono beneficiare di questa associazione con atezolizumab. Lo stato di espressione di PD-L1 nello studio IMpassion130 è stato valutato con il kit di immunoistochimica VENTANA PD-L1 (SP142). Il profilo di sicurezza nel braccio atezolizumab e nab-paclitaxel è apparso coerente con i profili di sicurezza noti dei singoli farmaci oggetto dello studio, e non sono stati identificati nuovi segnali di sicurezza con l’impiego di tale associazione. La natura e l'incidenza degli eventi avversi severi (SAE) e degli eventi avversi di grado 3-4 (AE) sono risultati coerenti con i profili di sicurezza noti dei due farmaci o con la patologia stessa. Sono stati segnalati dei SAE nel 23% delle pazienti trattate con atezolizumab più nab-paclitaxel, rispetto al 18 per cento delle pazienti trattate con la sola chemioterapia. Gli AE di grado 3-4 sono stati riportati nel 49 per cento dei soggetti che hanno ricevuto atezolizumab più nab-paclitaxel rispetto al 42 per cento dei soggetti sottoposti alla sola chemioterapia. Attualmente, sono in corso 7 studi di Fase III su atezolizumab nel TNBC, compresi gli stadi iniziali e avanzati della malattia. (FABRIZIA MASELLI)