
Ok del CHMP per ranibizumab nella retinopatia del prematuro
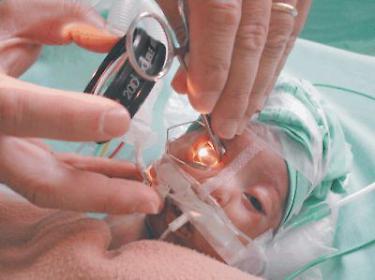
Oggi la chirurgia laser agisce distruggendo il tessuto retinico anomalo responsabile dell'aumento di fattore di crescita dell'endotelio vascolare (VEGF), mentre ranibizumab ne contrasterà gli aumentati livelli
Il Comitato per i medicinali per uso umano (Chmp, Committee for Medicinal Products for Human Use) dell'Agenzia europea per i medicinali (Ema, European Medicines Agency) ha raccomandato l'approvazione di Lucentis (ranibizumab) per il trattamento della retinopatia del prematuro (Rop) nei neonati pretermine. Si tratta di una rara malattia della retina, nonché una delle principali cause di cecità infantile, causata dallo sviluppo anomalo dei vasi sanguigni della retina nel neonato prematuro, e la progressione della malattia è dovuta ai livelli elevati di un fattore di crescita chiamato Vegf. Dopo parto prematuro, l'ipossia a cui è sottoposto il tessuto retinico provoca livelli elevati di Vegf e di conseguenza lo sviluppo anormale dei vasi sanguigni della retina, il quale può provocare anomalie strutturali come il distacco della retina stessa, con conseguente compromissione della vista o cecità. La Commissione europea esaminerà il parere del Chmp e si prevede emetterà la sua decisione finale entro tre mesi. Se verrà approvato per questa indicazione, ranibizumab sarà la prima e unica terapia farmacologica indicata per la Rop in questa popolazione di pazienti particolarmente vulnerabili. La domanda di approvazione è basata sullo studio clinico randomizzato e controllato RAINBOW, il quale ha dimostrato che, nei bambini con Rop, ranibizumab è efficace e con un buon profilo di tollerabilità. La chirurgia laser – che al momento rappresenta lo standard terapeutico – agisce distruggendo il tessuto oculare responsabile dell'aumento del Vegf e può essere associata a significative complicanze. Sebbene sia un trattamento efficace, esiste un evidente bisogno insoddisfatto di metodi innovativi per trattare la Rop che tramite un diverso meccanismo d'azione, non distruggano il tessuto retinico. A differenza della chirurgia laser, ranibizumab è in grado di ridurre i livelli intraoculari aumentati di Vegf – che sono la causa alla base dei processi patologici della Rop. Se approvato nella UE, ranibizumab (nella dose da 0,2 mg) sarà indicato per il trattamento dei neonati prematuri con Rop in zona I (stadio 1+, 2+, 3 o 3+), in zona II (stadio 3+) o con una forma grave di Rop definita ‘aggressive posterior' (AP-ROP). “Considerando questa popolazione di pazienti particolarmente vulnerabili e i limiti dei trattamenti attuali, gli studi clinici controllati e randomizzati sono importanti per garantire un uso sicuro ed efficace delle terapie farmacologiche nelle popolazioni di pazienti pediatrici. Se sarà approvato, ranibizumab rappresenterà una valida alternativa alla terapia laser”, ha commentato il professor Andreas Stahl, direttore del Dipartimento di Oftalmologia del Centro medico universitario di Greifswald. “Riconosciamo l'importanza di investire in programmi clinici atti sia ad assicurarsi l'autorizzazione all'Immissione in commercio, sia a garantire un uso sicuro delle terapie farmacologiche nelle popolazioni vulnerabili di pazienti pediatrici – ha affermato Dirk Sauer, Development Unit head di Novartis Ophthalmology – Siamo entusiasti di esserci ulteriormente avvicinati alla possibilità di rendere disponibile questo trattamento innovativo ai pazienti prematuri con ROP in tutta Europa. L'opinione positiva del CHMP è una testimonianza della nostra incessante dedizione all'innovazione, che perseguiamo affrontando i bisogni insoddisfatti e ridisegnando la cura dell'occhio in tutte le fasce d'età”. (FABRIZIA MASELLI)
Dai blog

"Anarchia la notte del giudizio": perché in sei ore può accadere di tutto







